Un vaccin révolutionnaire sans anticorps qui protège les macaques du virus VIS analogue du SIDA
L’équipe de chercheurs dirigée par Jean-Marie Andrieu, professeur à l’Université Paris Descartes, et Louis Wei Lu de l’Institut de Recherche pour le Développement (IRD), à Montpellier, a obtenu des résultats étonnants qui devraient mener au développement d’un vaccin du SIDA humain par une approche complètement inédite.
On sait que l’activation des lymphocytes CD4+ T, cellules capitales du système immunitaire, gouverne le premier stade de réplication du virus VIH (responsable du SIDA) et du virus VIS analogue chez le singe macaque. Ces chercheurs ont alors eu l’idée d’essayer, chez le singe macaque, un vaccin oral composé de Lactobacillum plantarum , bactérie hôte de l’intestin qui favorise la tolérance immunologique, et d’un virus inactivé du VIS. Cette association induit la non réponse des lymphocytes CD4+ T envers les antigènes du VIS, empêchant la réplication du virus et protégeant ainsi le macaque de l’infection. Sur 16 macaques ainsi traités qui furent ultérieurement exposés par voie rectale au VIS, 15 furent protégés de l’infection.
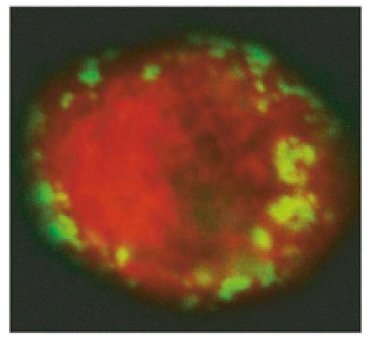
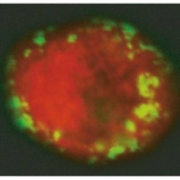
Cette photographie obtenue par fluorescence et
microscopie confocale montre le cytoplasme
(en rouge) d’un lymphocyte CD4+ T d’un des macaques
protégés par le vaccin tolérogène après exposition
au virus VIS. Les particules vertes sont des
protéines provenant du virus VIS. Il n’y a eu
aucune réplication du virus à l’intérieur de la cellule
CD4+ T. Crédit J.M. Andrieu et Wei Lu.
Ce vaccin oral tolérogène (offrant une une tolérance immunitaire à un antigène) induit des cellules CD8+ T régulatrices (Tregs). Celles-ci inhibent d’une part l’activation des cellules CD4+ T qui abritent le VIS et d’autre part la réplication ex vivo du VIS sans induire d’anticorps spécifiques du VIS ou des lymphocytes T cytotoxiques.
Un schéma simplifié du mécanisme classique d’immunité est celui ci :
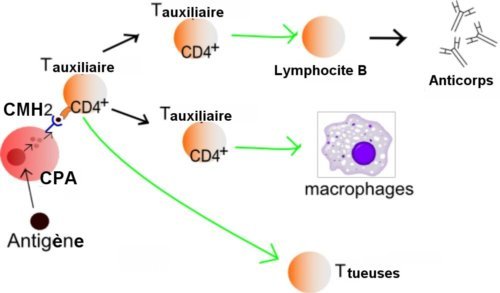
Les cellules présentatrices d’antigène (CPA) sont des cellules qui présentent des parties d’éléments intrus aux T CD4+. Ce sont soit des monocytes, soit le résultat de leur évolution, macrophages ou cellules dendritiques,soit des lymphocytes B. Le complexe majeur d’histocompatibilité de classe 2(CMH2) est une molécule présente à la surface des cellules CPA. Elle joue un rôle crucial de médiateur dans la présentation de l’antigène. Crédit Wikipedia Commons.
Les vaccins classiques ont pour but d’induire la production par l’organisme d’anticorps qui seront utilisés par le système immunitaire pour neutraliser les agents pathogènes.
Dans le cas de virus comme ceux du VIS ou du SIDA, ces mécanismes ne peuvent fonctionner. En effet, les cellules CD4+ T (lymphocytes T auxiliaires, porteurs à leur surface d’ un marqueur CD4+ ), chargées normalement d’activer d’autres cellules détruisant les intrus, sont justement les cellules où le virus pénètre et se réplique initialement. Les CD4+ T sont alors neutralisées, d’où un affaiblissement de toutes les défenses immunitaires.
Les premiers essais sur les macaques
Dans les premiers essais, huit macaques chinois ont été d’abord immunisés avec un mélange de virus VIS inactivé (VISi) et de Lactobacillus plantarum(LP), injecté dans l’estomac à l’aide d’une sonde. Quatre macaques témoins ont reçu uniquement du LP et quatre autres du VIS uniquement.
On fit alors des tests ex vivo (dans des cultures) en utilisant des fluides sanguins prélevés sur les singes.
Comme la tolérance immunologique se caractérise généralement par une non réponse aux antigènes, le premier test a été celui des anticorps du VIS. On n’en détecta pas dans le plasma des singes immunisés avec le LP/VISi tandis qu’on en détectait un faible taux dans celui des singes témoins traités au VISi.
Deux mois après les immunisations, on ne détecta pas de prolifération de cellules CD4+ T liées à des protéines spécifiques du VIS dans les huit singes immunisés au VISi/LP alors qu’on en détectait dans les quatre singes témoins traités au VISi seul.
Il y a donc eu, dans le cas des singes traités au LP/VISi, suppression de l’activation spécifique par le VIS des lymphocytes CD4+.
Des tests supplémentaires ont permis d’établir que cette suppression est due à l’action de cellules CD8+ T induites par le VISi en présence de LP. Ces cellules induites dans le système immunitaire ont des caractéristiques particulières. Elles ne sont pas cytotoxiques comme elles sont souvent dans les mécanismes classiques d’immunité, leur action est d’induire la suppression de l’activation positive par le VIS des CD4+T. Plus encore, les chercheurs ont montré que ces cellules dites T régulatrices (Tregs) pouvaient inhiber la réplication du VIS dans des CD4+ T fraîchement infectées ex vivo.
Tous les essais sur singes macaques ont été effectués au Tropical Medicine Institute, Guangzhou, University of Chinese Medicine, Guangzhou, Chine.
L’exposition des macaques à l’infection virale
Après avoir établi que l’immunisation par l’association VISi/LP induisait une tolérance immunitaire spécifique au VIS qui supprimait réplication virale ex vivo et activation des CD4+T, le tout sous l’action de CD8+T particulières, il fallait essayer si un tel vaccin » tolérogène » pouvait protéger les macaques d’une infection VIS par voie muqueuse.
Pour cela, on injecta par voie rectale une forte dose de VIS(souche mac239) aux huit macaques immunisés au VISi/LP et aux huit animaux de contrôle trois mois après l’immunisation. Les huit animaux immunisés furent complètement protégés et ne présentèrent aucun signe d’infection. Au contraire, les huit animaux témoins furent tous infectés. Les courbes ci-dessous représentent l’infection par le virus VIS mesurée par le nombre de copies de l’ARN du virus trouvées par millilitre dans le plasma de chaque animal.
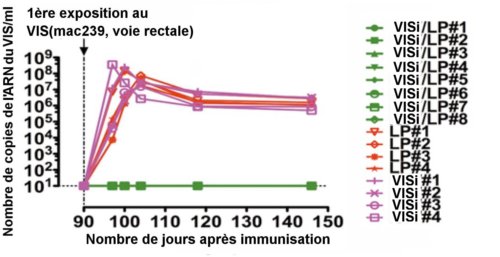
La courbe présente, en ordonnée, la densité d’ARN du VIS
mesurée dans le plasma des 16 animaux étudiés
(tableau de droite). On remarque que les huit macaques
immunisés au VISi/LP ne présentent pas d’infection(courbe verte)
à la différence des huit autres qui ont reçu soit du LP seul, soit du virus inactivé VIVi seul. Crédit J.M. Andrieu et Wei Lu.
Des mesures de l’ADN du VIS dans les mononucléaires du sang, monocytes et lymphocytes, (appelés PBMC, de l’anglais Peripheral Blood Mononuclear Cells) ont donné un résultat analogue.
Les macaques immunisés l’avaient été avec une préparation à base d’une souche de VIS mac239. Huit mois après la première exposition par voie rectale on en pratiqua une nouvelle avec une souche différente VIS B670. Les huit macaques restèrent entièrement protégés, ce qui démontre que le vaccin tolérogène fonctionnait toujours, probablement en empêchant l’activation des CD4+ T par une souche de virus VIS pourtant différente de celle utilisée pour la vaccination.
Etude de la durée d’immunisation
On immunisa un nouveau groupe de seize macaques, huit avec un mélange de virus VIS inactivé (VISi) et de Lactobacillus plantarum(LP), quatre macaques témoins avec uniquement du LP et quatre autres avecdu VISi uniquement. L’activité antivirale des cellules de ce groupe a été testé régulièrement. Sept des huit animaux qui avaient reçu du VISi/LP maintinrent leur activité antivirale ex vivo. Au 420ième jour après l’immunisation, les seize animaux furent exposés au virus VIS(mac 239) par voie rectale. Sept des huit macaques immunisés par le VISi/LP présentaient toujours une immunité totale, l’un de ceux-ci, les quatre traités au VISi seul et les quatre traités au LP seul étaient entièrement infectés. Le contrôle de l’activité antivirale ex vivo avait permis de prédire, à partir du 360ième jour après l’immunisation, lequel des huit singes immunisés ne serait pas protégé.
Avec les deux groupes d’essais, on a obtenu que, sur seize singes traités au VISi/LP, quinze d’entre eux étaient immunisés totalement par rapport à une exposition au VIS par voie rectale.
La protection contre l’infection par le SIV obtenue sur les macaques, corrélée avec l’effet protecteur in vitro, est tout à fait marquante. Comme le VIH, virus de l’immunodéficience humaine, est extrêmement proche du VIS et que, comme celui-ci, il exige des cellules immunitaires activées pour se répliquer, cette approche vaccinale tolérogène peut ouvrir une voie pleine de promesse dans la recherche d’un vaccin contre le virus VIH du SIDA. En outre, l’induction de CD8 +Tregs pourrait être utilisée en thérapeutique pour stopper la réplication du HIV et prévenir ainsi la progression de la maladie du SIDA en remplaçant les thérapies antivirales actuelles. Le concept de vaccin tolérogène pourrait être exploité dans la lutte contre de nombreuses affections immunitaires et avoir de fortes implications dans nos connaissances en immunologie.
Pour en savoir plus :
Induction of CD8+ Regulatory T Cells
Protects Macaques against SIV Challenge
Wei Lu, Song Chen, Chunhui Lai, Weizhong Guo, Linchun Fu, and Jean-Marie Andrieu
Cell Reports 2, 1736–1746, December 27, 2012