Stockage d’ hydrogène et synthèse d’hydrazine par compression de mélanges N2-H2
Par compression de mélanges de diazote N2 et de dihydrogène H2 , des chercheurs du CEA, du CNRS et des synchrotrons SOLEIL (Gif-sur-Yvette) et ESRF (Grenoble) ont obtenu des composés stœchiométriques dont l’un d’eux, (N2)6(H2)7 , présente une structure particulière où des « cages » d’azote enserrent des molécules d’hydrogène. Si on applique à ce composé une très haute pression (de l’ordre de 50 gigapascals (soit 500 mille fois la pression atmosphérique normale ; 1GPa=109 pascals), on obtient après décompression, de l’azote (N2), et de l’hydrazine (N2H4). Ce résultat nouveau démontre la possibilité de réactions chimiques sous pression, sans catalyseur, dans des mélanges de molécules simples. Une voie nouvelle s’ouvre tant pour le stockage de l’hydrogène que pour la synthèse « propre » de matériaux à haute densité comme l’hydrazine et les composés dérivés utilisés dans la propulsion spatiale.
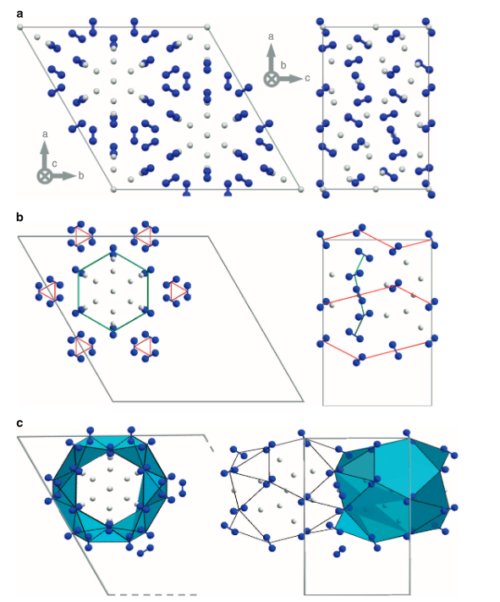
Fig.1. Structure cristalline du composé stoechiométrique (N2)6(H2)7 .
a) La diffraction aux rayons X révèle que des amas de molécules d’hydrogène H2 (représentées en gris) sont confinés dans des canaux formés d’un réseau de molécules de diazote N2 (représentées par les petites haltères bleues).
b) Des chaînes d’N2 en hélice (indiquées par les traits rouges) contraignent des molécules d’N2 intermédiaires à se placer en arrangement hexagonal (indiqué en trait vert) à peu près dans le plan cristallographique .
Ceci génère des canaux formés de volumes d’azote formant cages (figurées en bleu clair) le long d’axes parallèles à l’axe c du cristal. Chaque case héberge 15 molécules d’H2. Deux d’entre elles sont partagées avec les cages voisines.
Sur la colonne de gauche, on voit la structure cristalline perpendiculairement à l’axe c. Cet axe est l’axe de symétrie hexagonal, normal à tous les arrangements hexagonaux. A droite, vue de la structure perpendiculairement à l’axe b, le plan de la figure est parallèle à l’axe c. Crédit Nature communications.
Le solide cristallin (N2)6(H2)7 (figure 1) a été obtenu par compression à température ambiante à partir d’une pression de 5 Gpa. Cette structure est de type clathrate, dans laquelle ce sont des interactions de faible intensité (van der Waals) et non des liaisons chimiques fortes qui unissent les atomes du composé.
Les chercheurs ont appliqué à des mélanges N2 – H2 de diverses concentrations en H2 des pressions extrêmes obtenues dans une cellule à enclumes de diamant.
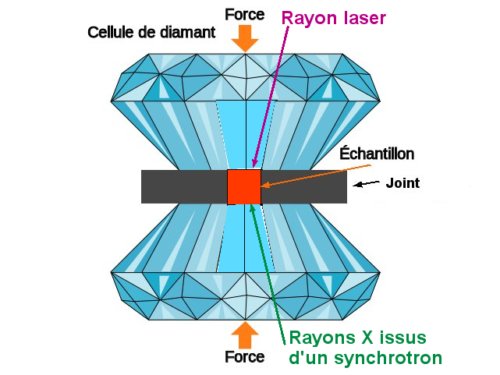 La figure n’est pas à l’échelle : le diamètre de l’échantillon pressé entre les deux enclumes de diamant est de l’ordre de 20 à 200 micromètres. Cette très faible surface S entraîne une très forte pression F/S sur l’échantillon. L’extrême dureté du diamant lui permet de supporter de très grandes forces. On peut, grâce à sa transparence sur une large bande du spectre électromagnétique, caractériser les échantillons in situ.
La figure n’est pas à l’échelle : le diamètre de l’échantillon pressé entre les deux enclumes de diamant est de l’ordre de 20 à 200 micromètres. Cette très faible surface S entraîne une très forte pression F/S sur l’échantillon. L’extrême dureté du diamant lui permet de supporter de très grandes forces. On peut, grâce à sa transparence sur une large bande du spectre électromagnétique, caractériser les échantillons in situ. C’est ainsi qu’a été obtenue, à température ambiante, la courbe de la figure 2 ci-dessous qu’on appelle « diagramme de phase » et qui permet de connaître les états du mélange étudié. On y remarque deux composés stœchiométriques stables (droites verticales en tirets), dont la composition ne varie pas quand la pression est supérieure à 5Gpa.
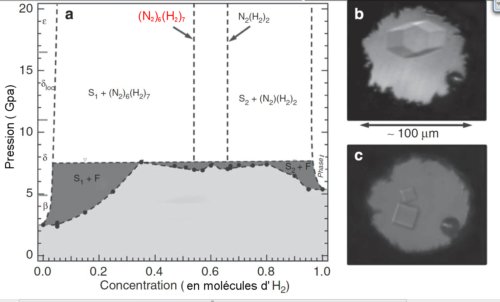
Fig.2.
a) Diagramme de phase du mélange binaire N2-H2 à température ambiante. On observe deux composés stables (dits stœchiométriques) pour des concentrations de molécules d’hydrogène H2 de 54%
et 66% (droites verticales en tirets). C’est le composé à 54% de H2, (N2)6(H2)7 qui a la forme cristalline de la figure 1 et présente les propriétés de stockage de l’hydrogène. En dehors de ces concentrations, on a un mélange entre l’un de ces composés et un solide riche en azote (S1) ou un solide riche en hydrogène (S2). S+F indique un mélange solide-fluide à l’équilibre.
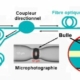
b) Microphotographie d’un monocristal de (N2)6(H2)7, de symétrie hexagonale.
c) Microphotographie d’un monocristal de l’autre composé stable N2(H2)2 , de symétrie cubique. Crédit Nature communications.
La structure en cage du composé (N2)6(H2)7 en fait un composé réservoir d’hydrogène. Si on augmente la pression, vers 50 GPa, ce composé voit sa structure modifiée, il devient amorphe. A la décompression, on obtient un mélange d’azote et d’hydrazine (N2 H4).
 L’hydrazine est un carburant toujours utilisé dans les fusées en mélange avec la diméthylhydrazine asymétrique (Aerozine 50). On le fait réagir avec l’oxydant peroxyde d’azote, N2O4. C’est ce mélange ( » propergol « ) qui a permis les décollages depuis la Lune. L’hydrazine est également employée seule par décomposition catalytique dans des moteurs à faible poussée permettant le positionnement sur orbite des satellites, des navettes et des sondes spatiales.
L’hydrazine est un carburant toujours utilisé dans les fusées en mélange avec la diméthylhydrazine asymétrique (Aerozine 50). On le fait réagir avec l’oxydant peroxyde d’azote, N2O4. C’est ce mélange ( » propergol « ) qui a permis les décollages depuis la Lune. L’hydrazine est également employée seule par décomposition catalytique dans des moteurs à faible poussée permettant le positionnement sur orbite des satellites, des navettes et des sondes spatiales.Le cycle de pression décrit plus haut permet ainsi de synthétiser un matériau liquide énergétique, l’hydrazine, en partant uniquement d’azote et d’hydrogène et donc sans catalyseur polluant (ce qui n’est pas possible à pression ambiante). Ceci définit une nouvelle synthèse « propre » de matériaux énergétiques.
Pour en savoir plus :
Pressure-induced chemistry in a nitrogen-hydrogenhost–guest structure
Dylan K. Spaulding, Gunnar Weck, Paul Loubeyre, Frédéric Datchi, Paul Dumas3 & Michael Hanfland
Nature communications, 8 déc. 2014