Du silicium cristallin méso-poreux pour obtenir de l’hydrogène à partir d’eau et de soleil
Le silicium cristallin poreux présente de grandes potentialités tant dans l’industrie que dans la recherche. Jusqu’ici, on l’obtient par attaque chimique des cristaux de silicium, ce qui entraîne à la fois un coût élevé et une grande perte de matériau qui en restreignent l’usage. Des chercheurs de Pensylvania State University, aux Etats-Unis, ont obtenu la synthèse complète de ce matériau sous sa forme mésoporeuse à partir de tétrachlorure de silicium Si Cl4. Ils ont ainsi obtenu un matériau dont les pores d’une taille de 5 à 15 nanomètres (un nanomètre = un millionième de mm) possèdent une énorme surface de contact exploitable pour de nombreuses applications. En particulier, les propriétés photo-voltaïques et photocatalytiques du silicium cristallin mésoporeux permettent de l’utiliser pour la conversion directe d’eau en hydrogène à partir de l’énergie solaire.
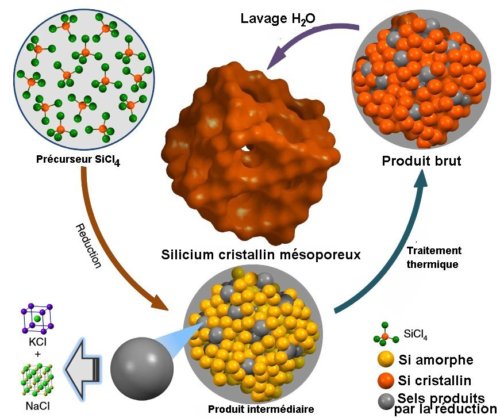
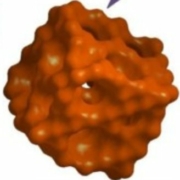
Fig.1. Schéma de la synthèse du Silicium cristallin mésoporeux. Ce dessin très schématique représente de façon approximative la structure des produits en jeu. Crédit Donghai Wang, Nature communications.
La synthèse (figure 1) est basée sur la réduction du tétrachlorure de silicium qui est aisé à obtenir et peu coûteux. En utilisant comme agent de réduction un alliage sodium-potassium NaK, on obtient, à température ambiante et sous atmosphère neutre d’argon, la formation de particules de silicium amorphe et non cristallin comme avec les autres méthodes de synthèse. La réaction produit des sels (chlorures de sodium et de potassium) qui précipitent avec Si pour constituer une matrice solide. Par traitement thermique, le Si amorphe est ensuite converti en une charpente de particules cristallines entremêlée de sels. Un lavage à l’eau élimine les sels et fournit le produit poreux final. En modifiant la température du traitement thermique, on peut faire varier la taille des pores de 5 à 15 nanomètres, la taille des particules et donc l’aire totale de contact.
La figure 2 ci-dessous présente une micrographie du produit intermédiaire obtenue par microscopie électronique en transmission.

Fig.2. Image en microscopie électronique par transmission du
produit brut de réduction avant lavage. Le silicium mésoporeux contient
des chlorures de sodium et de potassium intriqués dans sa matrice.
Crédit Donghai Wang /PennState.
La figure ci-dessous présente une micrographie du produit final,

Fig.3. Image du produit final. Après lavage à l’eau les sels de sodium et de potassium sont .
éliminés. Seule subsiste la carcasse de Si cristallin mésoporeux.
Crédit Donghai Wang /PennState.
L’hydrogène constitue un carburant propre et écologique dont la combustion ne produit que de la vapeur d’eau. Le produire en utilisant l’énergie solaire pour l’extraire de l’eau est particulièrement intéressant. Les semi-conducteurs, comme le silicium, sont capables, sous l’effet de la lumière solaire de générer des électrons. Ceux-ci peuvent fournir de l’électricité dans des dispositifs photovoltaïques comme les panneaux solaires.
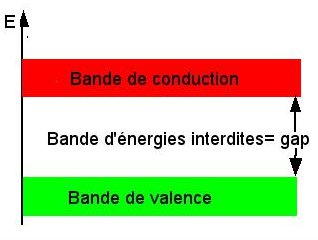 A basse température, la bande de valence est pleine d’électrons, celle de conduction est vide. Entre ces deux bandes existe une bande interdite aux porteurs de charge appelée « gap », mais cette différence d’énergie est faible (1.12 électron-volt* dans le silicium). Par excitation lumineuse, des électrons de la bande de valence (la plus basse en énergie) peuvent passer dans la bande de conduction. Ils sont appelés électrons libres et peuvent assurer la conduction de courant électrique. Pour que les électrons libres ne viennent pas se recombiner dans la bande de valence mais fournissent du courant, on utilise une jonction faite de deux régions P et N du semi-conducteur dopées** par des impuretés différentes. Dans un semi-conducteur dopé N, on a un excès d’électrons négativement chargés. C’est l’inverse pour le type P. Entre les deux matériaux existe donc un champ électrique qui va forcer les électrons libres à se diriger vers une surface du matériau, créant une tension électrique entre ses deux faces : c’est l’effet photovoltaïque utilisé dans les panneaux solaires.
A basse température, la bande de valence est pleine d’électrons, celle de conduction est vide. Entre ces deux bandes existe une bande interdite aux porteurs de charge appelée « gap », mais cette différence d’énergie est faible (1.12 électron-volt* dans le silicium). Par excitation lumineuse, des électrons de la bande de valence (la plus basse en énergie) peuvent passer dans la bande de conduction. Ils sont appelés électrons libres et peuvent assurer la conduction de courant électrique. Pour que les électrons libres ne viennent pas se recombiner dans la bande de valence mais fournissent du courant, on utilise une jonction faite de deux régions P et N du semi-conducteur dopées** par des impuretés différentes. Dans un semi-conducteur dopé N, on a un excès d’électrons négativement chargés. C’est l’inverse pour le type P. Entre les deux matériaux existe donc un champ électrique qui va forcer les électrons libres à se diriger vers une surface du matériau, créant une tension électrique entre ses deux faces : c’est l’effet photovoltaïque utilisé dans les panneaux solaires.*L’électron-volt est l’unité d’énergie couramment utilisée en physique microscopique : 1 eV = 1.6 10-19 joule.
**Le dopage des semi-conducteurs s’effectue par alliage d’infimes quantités de métalloïdes qui leur confère des propriétés électriques spécifiques.
L’ électricité de panneaux photovoltaïques peut évidemment servir à réaliser l’électrolyse de l’eau et fournir ainsi de l’hydrogène.
Mais les électrons libres produits dans un semi-conducteur, peuvent, s’ils ont assez d’énergie pour surmonter l’énergie de liaison de l’oxygène et de l’hydrogène, réaliser directement, en présence de catalyseurs adaptés, une réduction photo-catalytique de l’eau. Le silicium cristallin mésoporeux permet de faire encore mieux, puisqu’il joue à la fois le rôle de catalyseur et celui de convertisseur de photons en électrons. Les particules du Si cristallin mésoporeux ont de nombreux pores et cela leur confère une énorme surface, d’où leur effet catalytique.
De plus le caractère divisé du silicium mésoporeux augmente la bande interdite du semi-conducteur (qui devient ≈ 1.62eV), cela lui permet d’absorber plus d’énergie solaire.
Les chimistes de PennState ont mesuré l’effet photo-catalytique du Si cristallin mésoporeux recuit à 600°C et raffiné par attaque acide. Ils ont trouvé une production d’hydrogène équivalente à la meilleure de celles obtenues avec d’autres photo-catalyseurs. Le silicium cristallin mésoporeux a l’avantage d’avoir une durée de vie bien plus importante.
Le procédé de synthèse n’est actuellement qu’au stade du laboratoire, mais, comme il existe déjà dans l’industrie chimique des utilisations de l’alliage sodium potassium on pense qu’il sera assez aisé de l’étendre au stade industriel. Il faudra aussi maîtriser l’oxydation du silicium dans le processus catalytique pour augmenter encore sa durée de vie.
Une autre application de ce nouveau matériau à l’énorme surface de contact pourrait être l’obtention d’anodes performantes pour les accumulateurs Lithium-ion.
Pour en savoir plus :
Bottom-up synthesis of high surface area
mesoporous crystalline silicon and evaluation
of its hydrogen evolution performance
Fang Dai, Jiantao Zai, Ran Yi, Mikhail L. Gordin, Hiesang Sohn, Shuru Chen & Donghai Wang
Nature Communications, 10 apr. 2014, DOI :10.1038/ncomms4605