Convertir à bas coût le CO2 en hydrocarbures.
La conversion du CO2 en hydrocarbures est une opération qui a un intérêt économique si elle s’effectue grâce à une source d’énergie peu coûteuse avec un bon rendement énergétique ainsi qu’avec le recours à des composants simples et bon marché. Le couplage d’une cellule photovoltaïque à une cellule d’électrolyse qui effectue la réduction du CO2 en est une possibilité.
Une équipe de chercheurs du Collège de France, du Muséum d’histoire Naturelle, Paris, de l’Université Paris-Saclay, de la Benemérita Universidad Autónoma de Puebla, Puebla, Mexique, de l’École Polytechnique Fédérale de Lausanne, Suisse et du Politecnico di Torino, Turin, Italie, a réussi à réaliser un système de ce type qui a un rendement final (énergie chimique des hydrocarbures produits/énergie solaire consommée) de 2,3 % en utilisant des matériaux bon marché extrêmement répandus sur la planète.
La transformation du dioxyde de carbone produit, par exemple, par la combustion de combustibles fossiles demande au moins autant d’énergie que celle responsable de son émission. Si on utilise une cellule photovoltaïque fournissant une énergie gratuite à une cellule d’électrolyse qui oxyde l’eau à son anode et réduit le CO2 à sa cathode pour le convertir en composés organiques denses (hydrocarbures ou composés destinés à l’industrie chimique), on se rapproche d’un modèle d’énergie renouvelable.
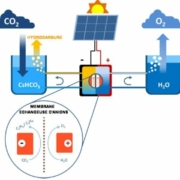
La figure 1 ci-dessous schématise un tel système :
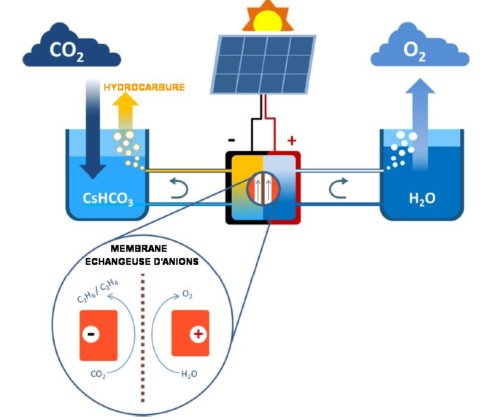
Fig.1. Schéma de l’ensemble photovoltaïque et électrochimique.
Le système absorbe un flux de CO2 qu’il réduit (à la cathode) et rejette de l’oxygène provenant de l’oxydation de l’eau à l’anode.
Tiré de Low-cost high-efficiency system for solar-driven conversion of CO2 to hydrocarbons
Tran Ngoc Huan, Daniel Alves Dalla Corte, Sarah Lamaison, Dilan Karapinar, Lukas Lutz, Nicolas Menguy,
Martin Foldyna, Silver-Hamill Turren-Cruze, Anders Hagfeldt, Federico Bella, Marc Fontecave and Victor Mougel,
PNAS | May 14, 2019 | vol. 116 | no. 20 | 9735–9740 Sup. Inf.
Pour qu’un tel système soit économique et de bon rendement, il faut d’abord que les catalyseurs nécessaires à la réaction de réduction du CO2 et à l’oxydation de l’oxygène de l’eau soient stables et obtenus à partir de métaux abondants sur la planète. Il faut aussi que l’opération se déroule dans des conditions de faible acidité (pH modéré) pour éviter la corrosion. Il faut que la cellule d’électrolyse soit prévue pour maximiser ,le rendement et limiter les pertes d’énergie électrique. Enfin, il faut qu’elle soit couplée à un système photovoltaïque peu onéreux. Les chercheurs ont satisfait à toutes ces conditions.
Ils ont ainsi obtenu la réduction du CO2.en hydrocarbures (éthylène et éthane) avec un rendement énergétique de 21%. Le couplage de cette cellule à un module photovoltaïque en pérovskite (cf le blog du 16 Janvier 2017 : Des cellules solaires en pérovskite atteignent un rendement de 20%) entraîne un rendement final (énergie chimique des hydrocarbures produits/énergie solaire consommée) de 2,3%.
La cellule d’électrolyse
Le rendement de la cellule d’électrolyse dépend fortement des catalyseurs utilisés. Il faut que les deux réactions redox à la cathode et à l’anode ne donnent lieu qu’à des pertes électriques par effet Joule limitées. Celles-ci se produisent surtout dans le cas où le potentiel nécessaire pour la réaction est trop élevé.
Les chercheurs ont donc conçu une cellule à deux compartiments, l’un anodique, l’autre cathodique, séparés par une membrane échangeuse d’anions. L’électrolyte du compartiment cathodique est une solution aqueuse à 0,1 Mole de bicarbonate de césium, celle du compartiment anodique une solution à 0,2 Mole de carbonate de césium.
Ce système (Fig.2.) opère à des densités de courant de 25 mA/cm2 et des différences de potentiel inférieures à 3 V, basse tension adaptée au couplage à des cellules photovoltaïques.
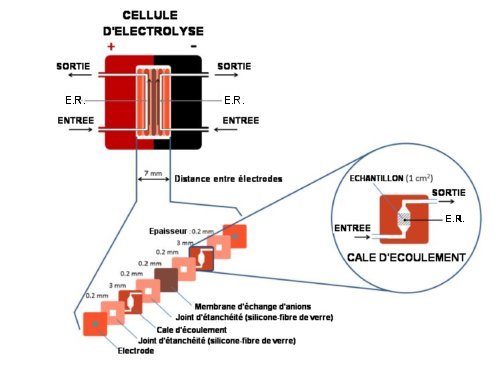
Fig.2. Schéma de la cellule d’électrolyse
Le système opère à flux continu la réduction de CO2 (à la cathode) et l’oxydation de l’eau (à l’anode). E.R. désigne l’électrode de référence.
Tiré de Low-cost high-efficiency system for solar-driven conversion of CO2 to hydrocarbons
Tran Ngoc Huan, Daniel Alves Dalla Corte, Sarah Lamaison, Dilan Karapinar, Lukas Lutz, Nicolas Menguy,
Martin Foldyna, Silver-Hamill Turren-Cruze, Anders Hagfeldt, Federico Bella, Marc Fontecave and Victor Mougel,
PNAS | May 14, 2019 | vol. 116 | no. 20 | 9735–9740 Sup. Inf.
Le catalyseur choisi pour la réduction du CO2 est basé sur l’oxyde de cuivre et particulièrement adapté à la réduction du CO2 en hydrocarbures. En outre, il fonctionne aussi pour l’oxydation de l’eau. On a pu ainsi l’utiliser à l’anode et à la cathode. Ceci présente aussi l’avantage d’éliminer l’empoisonnement de la cathode par le dépôt du métal utilisé pour l’anode. La forme et les dimensions de la cellule ont été choisies pour minimiser les pertes.
Un des facteurs diminuant le rendement de la conversion de CO2 est dû à la difficulté de son transport vers la surface de la cathode à cause de sa faible solubilité dans l’eau. Pour surmonter cela, on fait circuler continûment les électrolytes dans le système.
Pour augmenter les échanges d’anions, les chercheurs ont utilisé de l’oxyde de cuivre de structure dendritique nanoscopique (Fig.3.), ce qui augmente considérablement la surface utile des électrodes.

Fig.3. Images de la cathode de la cellule d’électrolyse au microscope électronique à balayage (MEB).
a) avant 1 H de réduction électrochimique de CO2 sous une tension de -1,0 V.
b) après cette réduction.
Tiré de Low-cost high-efficiency system for solar-driven conversion of CO2 to hydrocarbons
Tran Ngoc Huan, Daniel Alves Dalla Corte, Sarah Lamaison, Dilan Karapinar, Lukas Lutz, Nicolas Menguy,
Martin Foldyna, Silver-Hamill Turren-Cruze, Anders Hagfeldt, Federico Bella, Marc Fontecave and Victor Mougel,
PNAS | May 14, 2019 | vol. 116 | no. 20 | 9735–9740 Sup. Inf.
Avec ce type d’électrodes en oxyde de cuivre nano-structuré en dendrites, on obtient dans la cellule d’électrolyse un rendement de 21% pour la conversion de l’énergie électrique en éthylène et éthane.
Les chercheurs du Collège de France ont mis au point un véritable système artificiel analogue à la photosynthèse des végétaux. En effet les éléments de départ sont les mêmes, l’eau et le CO2 ; les produits sont des glucides pour les plantes, des hydrocarbures pour le système artificiel. Ce dernier est fabriqué à partir de métaux ordinaires et de matériaux bon marché.
Pour en savoir plus :
Low-cost high-efficiency system for solar-driven conversion of CO2 to hydrocarbons
Tran Ngoc Huan, Daniel Alves Dalla Corte, Sarah Lamaison, Dilan Karapinar, Lukas Lutz, Nicolas Menguy, Martin Foldyna, Silver-Hamill Turren-Cruze, Anders Hagfeldt, Federico Bella, Marc Fontecave and Victor Mougel,
PNAS | May 14, 2019 | vol. 116 | no. 20 | 9735–9740