Des hydrogels stimuli-excitables avec CRISPR-Cas
Des matériaux qui répondent à des stimuli biologiques trouvent nombre d’applications en biotechnologie. Citons la fabrication du squelette nécessaire à l’obtention de tissus biologiques, la commande de vannes micro-fluidiques, et la détection de substances chimiques.
J.J. Collins et une équipe du M.I.T.(Massachusetts Institute of Technology), Cambridge, USA et de Harvard University, Boston, USA ont utilisé les possibilités de programmation du système CRISPR-Cas pour agir sur des hydrogels contenant de l’ADN.
CRISPR est un acronyme pour clustered regularly interspaced short palindromic repeats, en français groupes de séquences répétées à intervalles réguliers qui constituent un segment d’ARN dit ARN guide (ARNg). Cas9 est une nucléase, l’enzyme protéine 9. CRISPR -Cas9 est un système à deux composants comprenant une molécule d’
Le segment ARNg sert à reconnaître la séquence de l’ADN cible à laquelle il se lie. L’enzyme coupe alors le double brin d’ADN aux extrémités de la séquence ARN.
On peut utiliser d’autres enzymes que la protéine 9, par exemple dans le système CRISPR-Cas12a .Celui-ci agit comme CRISPR-Cas9, mais a en outre la propriété collatérale de couper un ADN monobrin exogène quelconque s’il s’en présente un.
L’ enzyme nucléase est issue de bactéries qui l’utilisent pour se protéger de virus par un mécanisme analogue qui a conduit à la découverte du système CRISPR-Cas.
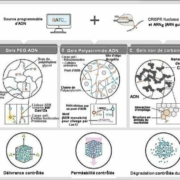
Les principaux systèmes hydrogels-CRISPR
1-des hydrogels à base de polyéthylène glycol (PEG) branché, orientés vers la délivrance de composés liés à de l’ADN (Fig.1.A).
2- des hydrogels polyacrylamide-ADN pour la délivrance de particules ou cellules vivantes encapsulées ou encore pour contrôler la perméabilité aux fluides de l’hydrogel via le clivage de liaisons ADN monobrin (Fig.1. B).
3- des hydrogels-ADN contenant du noir de carbone conducteur pour réaliser des circuits électriques ayant la propriété de s’ouvrir comme un fusible en réponse à l’effet déclencheur de la présence d’un ADN double brin spécifique au guide gARN (Fig.1.C).
La figure 1. ci-dessous décrit ces trois types principaux d’utilisation de l’effet mis au point par les chercheurs américains.
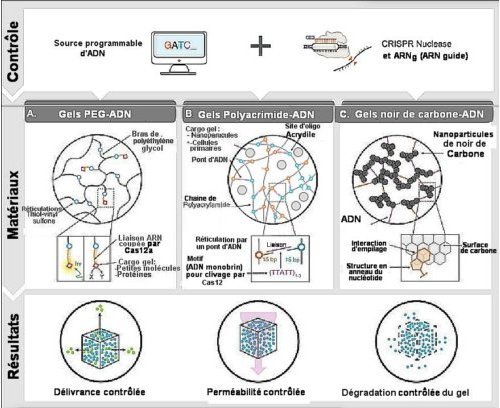
Fig.1. Modulation d’un hydrogel-ADN par CRISP
Les endonucléases Cas avec ARN-guide peuvent être aisément programmées pour des ADN spécifiques (bandeau du haut) et utilisées avec différents types chimiques d’hydrogels (bandeau du milieu) pour moduler les propriétés de ces systèmes de diverses façons. Citons la délivrance contrôlée de molécules, ou de particules ou encore de cellules vivantes, la variation contrôlée de la perméabilité de l’hydrogel et la dégradation contrôlée d’un matériau.
Tiré de Programmable CRISPR-responsive smart materials
Max A. English, Luis R. Soenksen, Raphael V. Gayet, Helena de Puig, Nicolaas M. Angenent-Mari, Angelo S. Mao, Peter Q. Nguyen, James J. Collins.
Science 23 Aug 2019: Supplementary materials
Vol. 365, Issue 6455, pp. 780-78. Avec autorisation.
Tous les CRISP-gels présentés sur la Fig.1. ont une réponse due à l’activation de Cas12a-ARNg grâce à la présence d’un ADN double brin cible . Ils exploitent la propriété spécifique de Cas12a de clivage de l’ADN cible ou l’autre propriété collatérale de Cas12a de clivage d’ADN monobrin non spécifique. Cette réponse modifie à grande échelle les propriétés des hydrogels.
La Fig.2. ci-dessous schématise le mécanisme d’activation de Cas12a
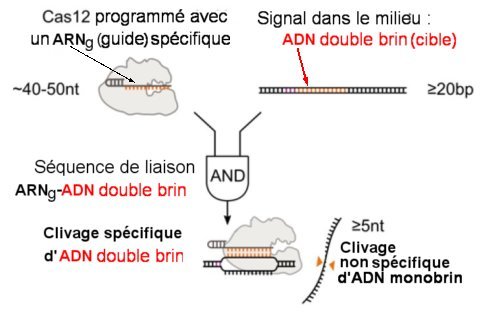
Fig.2. Activation de Cas12a par un ADN double brin.
La séquence spécifique de Cas12a est programmée par un ARNg.
La reconnaissance et le clivage de l’ADN double brin correspondant active aussi le clivage collatéral d’ADN simple brin non spécifique.
Tiré de Programmable CRISPR-responsive smart materials
Max A. English, Luis R. Soenksen, Raphael V. Gayet, Helena de Puig, Nicolaas M. Angenent-Mari, Angelo S. Mao, Peter Q. Nguyen, James J. Collins.
Science 23 Aug 2019: Supplementary materials
Vol. 365, Issue 6455, pp. 780-78. Avec autorisation.
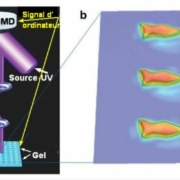
Ces hydrogels à CRISPR ont servi à M.A. English et al à mettre en œuvre plusieurs réponses fonctionnelles comme l’a vu ci-dessus. La combinaison de plusieurs de celles-ci leur a permis de réaliser à partir d’un hydrogel –polyacrimide sur papier un système microfluide avec lecture électrique qui permet de mesurer des concentrations infimes, inférieures à la nanomole (10-9 mole) d’ADN double brin. Ceci constitue un outil rapide, sensible et bon marché de détection des virus. Mieux encore, l’équipe a incorporé une radio-étiquettes
(RFID tag en anglais pour Radio Frequency Identification) miniature dans un système analogue au précédent mais où le déplacement du fluide peut court-circuiter une électrode interdigitée en argent, ce qui module le signal transmis (Fig.3.).
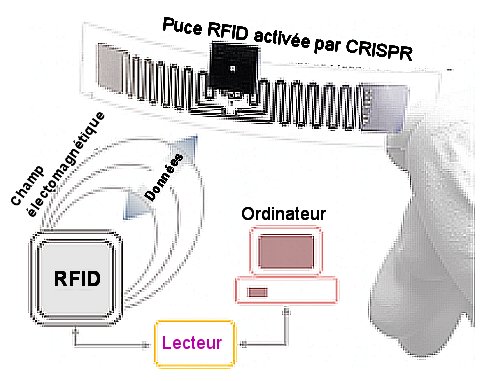
Fig.3. Schéma de la mesure en temps réel de la conductance d’un hydrogel grâce à un système RFID
Tiré de Programmable CRISPR-responsive smart materials
Max A. English, Luis R. Soenksen, Raphael V. Gayet, Helena de Puig, Nicolaas M. Angenent-Mari, Angelo S. Mao, Peter Q. Nguyen, James J. Collins.
Science 23 Aug 2019: Supplementary materials
Vol. 365, Issue 6455, pp. 780-78. Avec autorisation.
Les chercheurs du MIT ont ainsi mis au point plusieurs méthodes pour interfacer des signaux biologiques avec des hydrogels munis d’enzymes Cas que l’on peut programmer à volonté. Ces méthodes permettent de contrôler nombre de propriétés et de mécanismes complexes, comme la délivrance de molécules, de particules et de cellules vivantes, la désintégration en bloc d’un hydrogel, la transmission électronique d’un signal et la commande d’une vanne microfluidique
L’exploitation des propriétés enzymatiques deCas12a a permis de construire un système d’hydrogels versatile et programmable puisqu’il suffit de changer la molécule guide ARNg pour que l’hydrogel réponde à une séquence d’ADN donnée.
Pour en savoir plus :
Programmable CRISPR-responsive smart materials
Max A. English, Luis R. Soenksen, Raphael V. Gayet, Helena de Puig, Nicolaas M. Angenent-Mari, Angelo S. Mao, Peter Q. Nguyen, James J. Collins.
Science 23 Aug 2019: Supplementary materials
Vol. 365, Issue 6455, pp. 780-78.