Une arme nouvelle et sélective contre les bactéries
La résistance des maladies infectieuses aux antibiotiques, due au mésusage de ces derniers, se répand sur la planète depuis une vingtaine d’années. Ceci fait craindre que ces maladies ne redeviennent la cause principale de mortalité dans le monde. En effet, la mise au point de nouveaux antibiotiques est difficile et lente et ces derniers ne sont pas à l’abri du développement de nouvelles résistances.
Une équipe de chercheurs de l’Institut Pasteur, du CNRS et de l’Universidad Politécnica, Madrid, Espagne, ont inactivé une toxine en la scindant en deux à l’aide d’intéine. Ils ont ensuite su introduire les plasmides ainsi constitués dans des populations de bactéries par le procédé appelé conjugaison. La toxine n’est réactivée que dans les bactéries abritant des facteurs de transcription spécifiques. Ils ont utilisé cette technique pour cibler et tuer seulement les bactéries Vibrio cholerae résistantes aux antibiotiques présentes dans une population microbienne mixte contenant aussi des bactéries inoffensives et des Vibrio cholerae sensibles aux antibiotiques.
Cette remarquable sélectivité a pu être obtenue aussi bien in vitro que dans le microbiote du tube digestif du poisson zèbre ou de larves de crustacés, hôtes naturels de Vibrio spp.
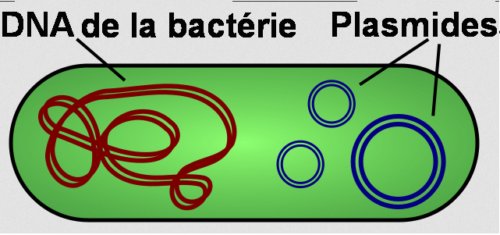
Un plasmide est une petite molécule d’ADN qui est séparée physiquement de l’ADN de la bactérie et peut se répliquer indépendamment.
On les trouve dans les bactéries généralement sous la forme d’une double hélice de molécules d’ADN enroulée en un petit cercle :
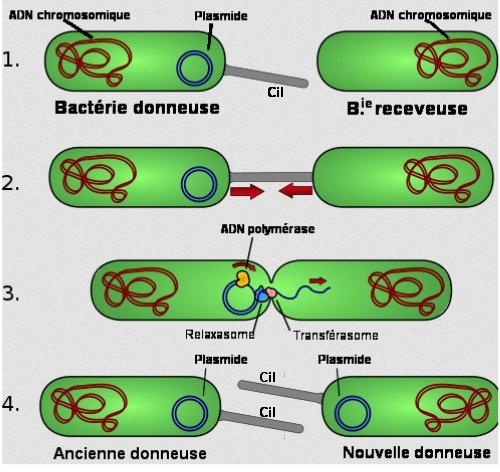
Les plasmides peuvent passer d’une bactérie à une autre par le processus de conjugaison schématisé ci-dessous :
Wikipedia CCA
Pour tuer les bactéries, les chercheurs ont choisi d’utiliser la toxine composante d’un système toxine-antitoxine dit de type II qu’on rencontre dans les plasmides et qui concourt à leur stabilité dans les bactéries lors des divisions successives de celles-ci. Les toxines et antitoxines de type II sont des protéines. Chaque antitoxine est spécifique de la toxine correspondante, ce qui évite des interactions non spécifiques. L’effet antimicrobien réside sur la régulation de la transcription des toxines antitoxine de type II par des facteurs de transcription hautement spécifiques. Ceci veut dire que l’activation de la toxine et la mort de certaines des bactéries d’une population bactérienne mélangée n’est possible que si
Les régions codantes de l’ADN sont transcrites en molécules d’ARN messager. Ces molécules d’ARNm sont ensuite traduites en séquences protéiques.
l’espèce de bactéries ciblée exprime le facteur de transcription régulateur de la toxine utilisée. La virulence du V. cholerae est coordonnée par un activateur de transcription appelé ToxR. Les épidémies de choléra sont actuellement liées à la résistance aux antibiotiques due à des gènes présents dans un élément du vibrion nommé SXT. Ce dernier encode des fonctions promotrices de son excision, sa dissémination par conjugaison et son intégration.
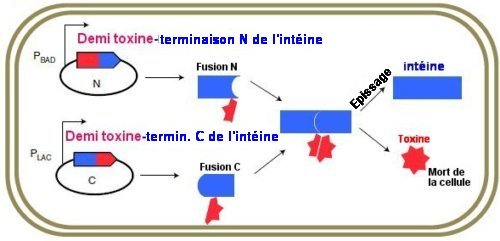
On savait que l’expression de la toxine à partir d’un promoteur Pab tuait Escherichia coli, bactérie présente dans notre tube digestif et qui n’y est pas nocive. Cela se produit, par exemple, lorsque, dans un plasmide contenant une toxine coupée en deux par une intéine, les processus de fusion puis d’épissage reconstituent la toxine (Fig.1).
Fig. 1. Représentation schématique de la production de toxine active
A l’intérieur d’une bactérie, dans des plasmides encodant une toxine scindée en deux (en rouge) avec une intéine scindée en deux (en bleu), le processus d’épissage reconstitue la toxine et l’intéine.
Adapté de Engineered toxin–intein antimicrobials can selectively target and kill antibiotic-resistant bacteria in mixed populations
Rocío López-Igual1, Joaquín Bernal-Bayard, Alfonso Rodríguez-Patón , Jean-Marc Ghigo and Didier Mazel .
Nature Biotechnology | 2019. Avec autorisation.
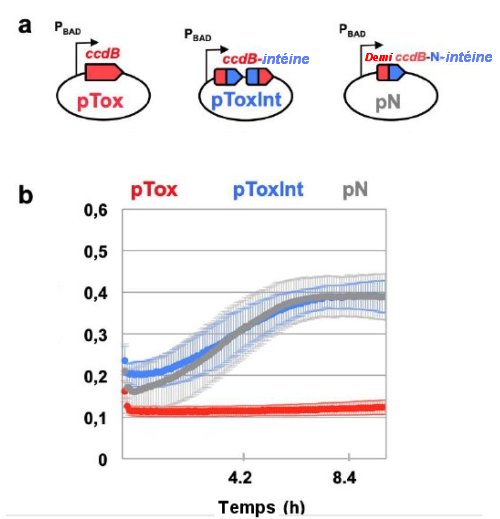
La figure 2 ci-dessous compare les toxicités d’une toxine entière pTox (gène ccdB) , de pToxint, la même toxine interrompue par l’intéine et de pN ,une demi toxine liée à la terminaison N de l’intéine.
Fig.2 Comparaison des toxicités d’une toxine entière avec la toxine interrompue par fusion avec une intéine.
a) Caractéristiques des plasmides pTox, pToxint, et pN. Le plasmide PTox contient la toxine (en rouge) de gène ccdb clonée sous le promoteur PBAD tandis que, dans PToxint ccdb est interrompu par l’intéine scindée dnaE(en bleu)dont les extrémités ont fusionné. Le plasmide pN (ccdB-dnae-N) est non toxique et sert de contrôle.
b) Courbes de croissance dans un milieu liquide de bactéries contenant les plasmides des trois types ci-dessus. Les vitesses de croissance des bactéries contenant le plasmide non toxique pN ou le plasmide pToxint sont les mêmes. Au contraire, les bactéries contenant le plasmide pTox ont une vitesse de croissance nulle.
Adapté de Engineered toxin–intein antimicrobials can selectively target and kill antibiotic-resistant bacteria in mixed populations
Rocío López-Igual1, Joaquín Bernal-Bayard, Alfonso Rodríguez-Patón , Jean-Marc Ghigo and Didier Mazel .
Nature Biotechnology | 2019. Avec autorisation.
Le module génétique conçu pour cibler V. cholerae résistant aux antibiotiques est basé sur la toxine CcdB scindée par une intéine, mais il faut d’abord que cette toxine-intéine ne puisse être activée que par ToxR, présent dans toutes les souches de V. cholerae. La solution retenue par les chercheurs a été de cloner un demi CcdB-intéine à terminaison N, l’autre, et un demi CcdB-intéine à terminaison C dans un seul plasmide appelé pU-BAD. Ce plasmide tue bien les vibrions du choléra mais est un peu instable dans ceux-ci.
Pour développer un antimicrobien stable basé sur une CcdB-intéine conjugable qui tue spécifiquement les V. cholerae dans des populations microbiennes de diverses bactéries, les chercheurs ont cloné de nouveau un élément toxine-intéine dans un plasmide nommé pPW doté de faculté de conjugaison. Puis, de façon analogue, ils ont fabriqué un autre plasmide, pABRW qui exprime sa toxine en présence de la protéine SXT présente dans les V. cholerae résistants aux antibiotiques. En combinant les plasmides pPW et pABRW en un seul plasmide pFW, on obtient un élément qui tue sélectivement les V. cholerae résistants aux antibiotiques.
Les chercheurs ont essayé leur plasmide à base de toxine-intéine dans trois milieux qui sont chacun un habitat naturel de ce pathogène : l’eau, le poisson-zèbre (Danio rerio) et un crustacé des lagunes et des lacs salés (Artemia nauplii) . Dans tous les cas, les bactéries du choléra résistantes aux antibiotiques étaient tuées à 100% tandis que les bactéries inoffensives restaient indemnes tant dans l’eau que dans les microbiotes des animaux.
Au dire des auteurs, en optimisant cette technique qui délivre des anti microbiens sélectifs, on devrait arriver à attaquer de nombreuses bactéries dangereuses en épargnant les bactéries utiles et sans le souci de voir des résistances se développer comme avec les antibiotiques.
Pour en savoir plus :
Engineered toxin–intein antimicrobials can selectively target and kill antibiotic-resistant bacteria in mixed populations
Rocío López-Igual1, Joaquín Bernal-Bayard, Alfonso Rodríguez-Patón , Jean-Marc Ghigo and Didier Mazel .
Nature Biotechnology |2019. https://doi.org/10.1038/s41587-019-0105-3